The patent term extension system originated from the U.S. Drug Price Competition and Patent Term Restoration Act (Hatch-Waxman Act) of 1984. Subsequently, many countries or regions such as Japan, South Korea, the European Union and Canada also established similar systems to compensate for the loss of patent protection period caused by the lengthy approval process for innovative drugs.
On January 15, 2020, China signed an economic and trade agreement with the United States, agreeing to add a patent term extension system to the Chinese Patent Law to compensate for losses caused by unreasonable delays in the patent authorization or drug marketing approval process. In June 2021, the revised Patent Law officially came into effect, and the patent term extension system officially began to be implemented in China. The new implementation rules and patent examination guidelines came into effect on January 20, 2024, detailing the implementation rules for China's patent term extension.
PTE Overview
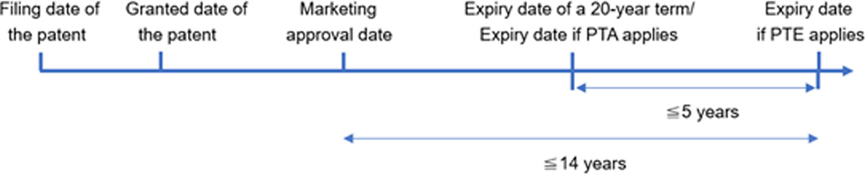
- Article 42, paragraph 3 of the revised Patent Law provides that, in order to compensate for the time spent on the approval of new drug marketing, the China National Intellectual Property Administration (CNIPA) may, at the request of the patentee, extend the term of invention patents related to new drugs that have been approved for marketing in China. The extension of the patent term shall not exceed five years, and the total effective patent term after the extension shall not exceed 14 years from the date of approval of the new drug marketing.
- This regulation aims to balance the high cost and long cycle of innovative drug development, ensuring that pharmaceutical companies can reasonably recover their R&D investments during the patent protection period, while also encouraging more new drug innovations and increasing companies' R&D enthusiasm.
Applicable drugs for patent term extension (PTE)
- Patent term extensions apply to product patents, preparation process patents, and medical use patents related to active pharmaceutical ingredients (APIs) contained in “new drugs”, which are innovative drugs and certain improved new drugs as defined in the drug regulatory laws and regulations of the National Medical Products Administration (NMPA). For a drug product to qualify as a “new drug” for patent term extension in China, it must be new globally, meaning that a new drug application (NDA) must be filed in China before it can be approved in other countries. However, it is not required that the NDA be approved in China before it can be approved in other countries.
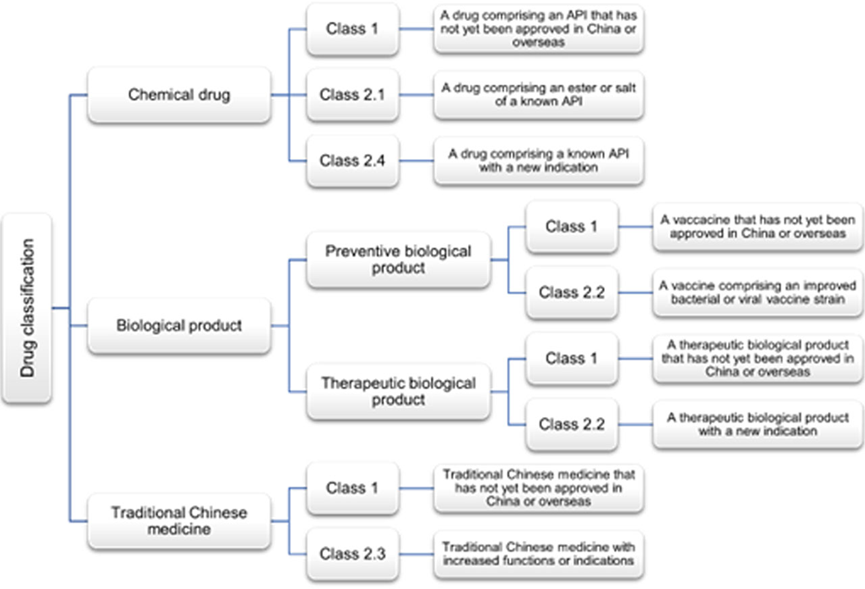
Innovative drugs that meet PTE conditions:
- According to the current drug classification regulations of NMPA, innovative drugs refer to Class 1 drugs and must be new globally. Eligible innovative drugs include the following drugs that have not yet been approved in China or overseas:
- Chemical drugs;
- preventive biological products – vaccines;
- Therapeutic biological products;
- traditional Chinese medicine.
Improved new drugs that meet PTE conditions:
- Improved new drugs must also be new globally and, according to the NMPA’s drug classification regulations, are limited to the following drugs:
- Esters or salts of known APIs in Class 2.1 of chemical drugs;
- Known APIs with new indications in Class 2.4 chemical drugs;
- Vaccines containing modified bacterial or viral strains in category 2.2 of preventive biological products;
- Therapeutic biological products with new indications in category 2.2 of therapeutic biological products;
- Traditional Chinese medicines in category 2.3 that have increased functions or indications.
Drugs that do not qualify for PTE:
- According to the above definition of "new drugs", imported drugs (i.e. drugs that have been marketed overseas when applying for marketing approval in China) do not meet the PTE conditions. Specifically, they include Class 5.1 chemical drugs, Class 3.1 and 3.2 preventive biological products, and Class 3.1 and 3.2 therapeutic biological products.
These provisions ensure that only drugs that are globally first-of-its-kind or significantly improved are eligible for patent term extensions, thereby encouraging true innovation and high-quality improvements.
The categories of drugs eligible for Patent Term Extension (PTE) are summarized in the table below:
Time limit for PTE application
- The patent owner or his agent should submit a request for patent term extension (PTE) within three months of obtaining marketing approval for a drug and pay the official fee. The application should be made after authorization by the marketing authorization holder.
Requirements for obtaining PTE
- To obtain a PTE in China, the following requirements need to be met:
- The grant date of the patent should be earlier than the approval date of the drug;
- When submitting a PTE request, the patent should be in valid status;
- The patent has not yet obtained a PTE;
- The patent claims should include technical solutions related to the drug; these technical solutions include the structure, composition and dosage of the approved new drug, as well as the approved manufacturing process and indications;
- If the drug is protected by multiple patents, only the term of one patent can be extended;
- If a patent covers multiple drugs, a PTE can only be applied for one of the drugs.
PTE time limit calculation
- PTE is an additional calculation outside of any Patent Term Adjustment (PTA), and the calculation of PTE should be done after the PTA decision is made. Due to the different reasons for compensation, the compensation periods of PTA and PTE can be accumulated.
- The calculation method of PTE is to subtract five years from the number of days between the application date of the Chinese patent and the approval date of the Chinese drug marketing. At the same time, PTE should meet the following two requirements: the maximum PTE period is five years, and the total effective patent period after the drug marketing approval shall not exceed 14 years.
Examination of PTE Request
- The examiner will give the patentee at least one opportunity to make comments or amendments before deciding whether to grant PTE compensation. If the requirements of PTE are met, CNIPA will grant PTE, notify the number of days the patent term is extended, and publish information such as the drug name, approved indications, and the original and new expiration dates of the patent in the Patent Gazette. If dissatisfied with the decision of CNIPA, the patentee or an interested third party may file an administrative reconsideration.
Scope of protection during the PTE period
- Since the purpose of PTE is to compensate for the time spent on the approval of new drugs, it is necessary to directly link the approved new drugs with the technical solutions of the drug patents for which PTE is applied. The technical solutions related to the new drugs will serve as a bridge between the marketed new drugs and the drug patents for which PTE is applied.
- The scope of protection of a PTE is narrower than that of a patent itself, limited to new drugs with approved indications, which means that the scope of protection of a PTE includes:
- New drug products in product claims for approved indications;
- New drugs with approved indications in medical use claims;
- The manufacturing process of new drugs for approved indications recorded by NMPA.
- A new indication may support a new PTE, but the scope of the PTE obtained will cover only the new indication on which the PTE is based and not any earlier or later approved indications.
- Therefore, when submitting a PTE request, the patent owner should provide materials for determining the scope of protection of the PTE, such as materials showing the composition of the approved drug, materials showing the approved drug indications, and materials on the drug manufacturing process approved by the NMPA.
in conclusion
Innovative drug companies should actively use China's PTE system to apply for patent term extension. When filing a PTE request, innovative drug companies should consider all factors, such as the type of claims, the scope of claims, the stability of the patent, the enforcement of the patent, the scope of the PTE, and the "one drug, one patent, one PTE" rule, to maximize and rationalize the patent term extension of one or more patents.
For generic drug companies, extending the patent term of innovative drugs will inevitably delay the time for generic drugs to enter the market, which will have a significant impact on many generic drug companies in China. Generic drug companies should pay close attention to the patent term of innovative drug companies and strategically plan to simplify the progress of new drug applications. If necessary, generic drug companies can also consider filing invalidation requests for the patents of innovative drug companies.
Delayed entry of generic drugs into the market will increase the royalties of drugs. It is particularly important for patent applicants to seek to balance the profits of innovative drug companies and generic drug companies. This balance has been taken into account when formulating the Patent Law and Implementing Regulations on PTE and is reflected in several requirements for obtaining PTE. For example, the requirements include that only patents that have not obtained PTE are eligible for PTE; if a drug is protected by multiple patents, the term of only one patent can be extended; if a patent covers multiple drugs, the patent can only apply for PTE for one of the drugs. In addition, it is stipulated that the maximum term of PTE is five years, and the total effective patent term after the drug is approved for marketing shall not exceed 14 years. These requirements not only effectively avoid repeated compensation for the patent term of innovative drug companies, but also prevent excessive extension of patent terms.
联系咨询
 | Get exact prices For the country / regionE-mail: mail@yezhimaip.com |

